| |
Адъюванты для вакцин Vaccine adjuvants
| |
Для исследований в области вакцин
Иммунные реакции делятся на два типа: врожденная и адаптивная (рисунок 1). Клетки врожденной иммунной системы распознают и реагируют на патогенные микроорганизмы неспецифическим образом. В иммунном ответе участвуют многие типы клеток: дендритные клетки - DC, макрофаги, тучные клетки, эозинофилы, нейтрофилы, В- и Т-лимфоциты [1]. Антиген-представляющие клетки (АРС) поглощают вторгающиеся патогенные микроорганизмы, переваривают их и переносят в локальный лимфатический узел, где они представляют антигены наивным Т-клеткам и направляют дифференцировку Т-хелперов в различные эффекторные клетоки (CD8 + Т-клетки / Th1, CD4 + Т-клетки / Th2). Врожденная иммунная система обеспечивает немедленную защиту от инфекции и имеет важное значение для эффективной индукции адаптивного иммунитета [2, 3]. В отличие от этого адаптивный иммунитет включает антиген-специфический ответ, опосредуемый Т-клетками, В-клетками и клетками памяти. Т- и В-клетки экспрессируют уникальные рецепторы Т-клеток (TCR) и рецепторы В-клеток (BCR), соответственно, и распознают различные антигены. Когда Т и В-клетки активируются, они индуцируют развитие цитотоксических Т-киллеров (клеточный иммунитет) и производство антител дифференцированными плазматическими В-клетками (гуморальный иммунитет). Запуск иммунного ответа требует взаимодействия между клетками врожденной и адаптивной иммунной системы.
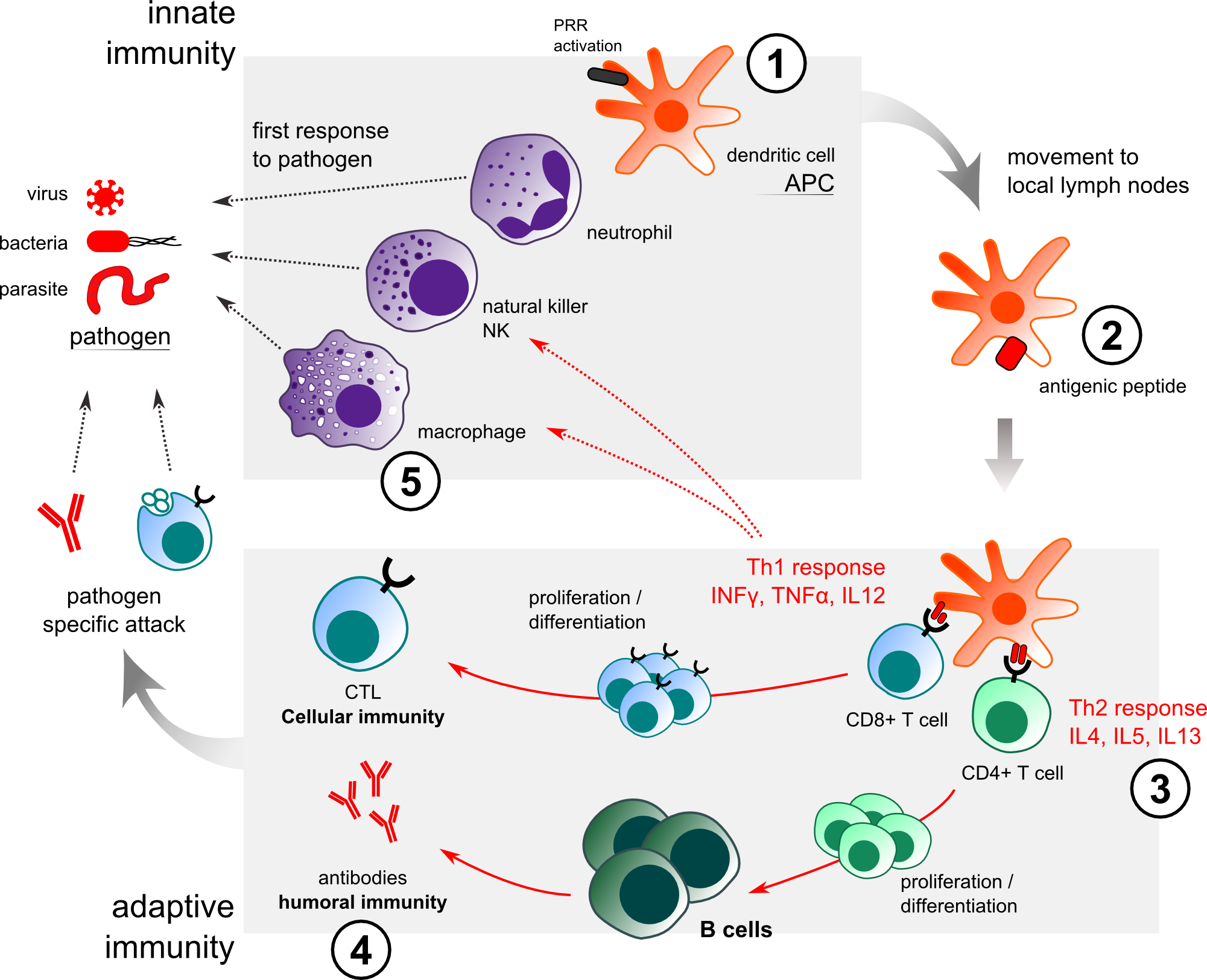
Рисунок 1. Врожденный и адаптивный иммунный ответ на действие патогена/адъюванта. VaxAlum / SqualVax / IFAVax: (1) привлечение APC к месту инъекции. (2) усиление захвата антигена. (3) усиление ответа Th2. (4) усиление гуморального иммунного ответа. (5) AlumVax: усиление образования NALP3/инфламмосом в макрофагах.
ROLE OF ADJUVANTS IN VACCINES & ANTIBODY PRODUCTION
Как правило, используются nри основных типа вакцины: I) живые ослабленные вакцины, II) инактивированные вакцины, которые представляют собой микроорганизмы, инактивированные химически или температурой и III) субъединичные вакцины, которые сделаны из компонентов патогена, таких как белки, пептиды или генетические материалы. Иммунизация или вакцинирование индуцируют специфический адаптивный иммунитет к патогену путем создания клеток памяти против конкретного патогена [2]. Любая вакцина состоит из специфической антигенной части патогена, который будет провоцировать ответ Т и В-лимфоцитов с производством клеток памяти. После введения антиген поглощается и презентируется АРС как комплекс пептид / белок МНС класса II или I, который связывается Т-клеточные рецепторы (TCR) Т-хелперов CD8+ (Th1) и CD4+ (Th2), соответственно. После индукции цитокинами АРС Т-хелперы дифференцируются в два основных подтипа: Th1 и Th2. Интерлейкины IL-2 и IL-12 способствуют дифференцировке Th1 и последующей секреции INF-гамма, TNF-альфа и высвобождению IgG2a, и пролиферации цитотоксических CD8+ Т-клеток. Это "клеточный ответ", который борется с внутриклеточными патогенами. IL-1b и IL-18 индуцируют дифференцировку Th2 приводят к секреции IL-4, -5, -6, -10 и -13 и пролиферации секретирующих антитела B-клеток: это "гуморальный ответ", который защищает организм от внеклеточных патогенов. Иммунный ответ, индуцируемый антигенной или генетической иммунизацией может, таким образом, отличаться по запуску одного из двух ответов: Th1 или Th2.
Успешное создание вакцин для некоторых патогенных микроорганизмов, вероятно, потребует расширенного иммуного ответа, включающего клеточный иммунитет Th1 или более надежный гуморальный ответ Th2.
Для получения антител предпочтительнее сильный ответ Th2. Качество поствакцинального иммунный ответа или уровень выработки антител будут зависеть от нескольких факторов, в том числе способа, числа и времени введения вакцины, от природы антигена и качества презентации антигена. Весь этот процесс облегчается адъювантами. Действительно, адъюванты позволяют преодолеть слабо иммуногенные свойства большинства белков, пептидов и ДНК-вакцин (не имеющих природных иммунных триггеров) или индукцию неадекватного иммунного ответа. Таким образом, адъюванты могут быть использованы для (1) усиления иммунного ответа, (2) ориентирования иммунный ответ за счет модуляции баланса Th1 / Th2 и (3) снижения количества антигена и количества инъекций, необходимых для индукции защиты.
КАК РАБОТАЮТ АДЪЮВАНТЫ?
Адъюванты, как правило, делятся на две группы: средства доставки и иммуностимуляторы с некоторыми общими компонентами. Средства доставки - это, как правило, частицы (минеральные соли, например, гидроксид алюминия, эмульсии, липосомы). Они несут и "показывают" клеткам выбранные антигены в множестве копий, имитируя естественную презентацию микроорганизмами и используются для осаждения антигенов в месте введения, или увеличения его доставки в АРС (микро- и наночастицы) [4]. В противоположность этому, иммуностимуляторы (агонисты TLR, сапонины, цитокины ...) непосредственно узнают и активируют клетки иммунной системы и усиливают иммунный ответ на антигены (рисунок 2). В этой группе адъювантов вещетсва, нацеленные на рецепторы распознавания патогена (РРСС) врожденной иммунной системы получили значительное внимание в течение последнего десятилетия.
Ключевые свойства адъюванта:
|
Увеличивает скорость, силу и длительность иммунного ответа
|
Позволяет расширить кросс-реактивность антител
|
Обеспечивает выбор или модулируют гуморальный или клеточный ответ
|
Уменьшает количество антигена, необходимое для защиты
|
Увеличивает иммунный ответ на вакцины в индивидумах с незрелой, подавленной или старческой иммунной системой
|
Увеличивает иммуногенность слабо иммуногенных антигенов
|
Модулирует изотип, подкласс, качество и специфичность антител
|
PRRs позволяют врожденным иммунным клеткам распознавать микробные или инфекционные компоненты, известные как патоген-связанные молекулярные паттерны (PAMPs) и компоненты, выделяющихся из травмированных или умирающих клеток, известные как молекулярные паттерны, связанные с повреждениями (DAMPS). Эти PAMPs и DAMPS, связывающиеся с РРСС, вызывают воспалительную реакцию, которая в свою очередь, усиливает адаптивный иммунный ответ [5]. Есть четыре класса PRR: Toll-подобные рецепторы (TLRs), Nod-подобные рецепторы (NLRs), RIG-1 подобные рецепторы (RLRs) и рецепторы лектинов С-типа (Clrs). Почти все члены семейства PRR считаются рецепторами адъювантов [6-9]. В последнее время возникла третья группа адъювантов, образованная комбинацией иммуностимуляторов и средств доставки в виде частиц. Она называется как «система адъювантов» или «комбинация адъювантов». Эта группа включает в себя сочетание агонистов TLR с Alum, эмульсиями или липосомами [10].
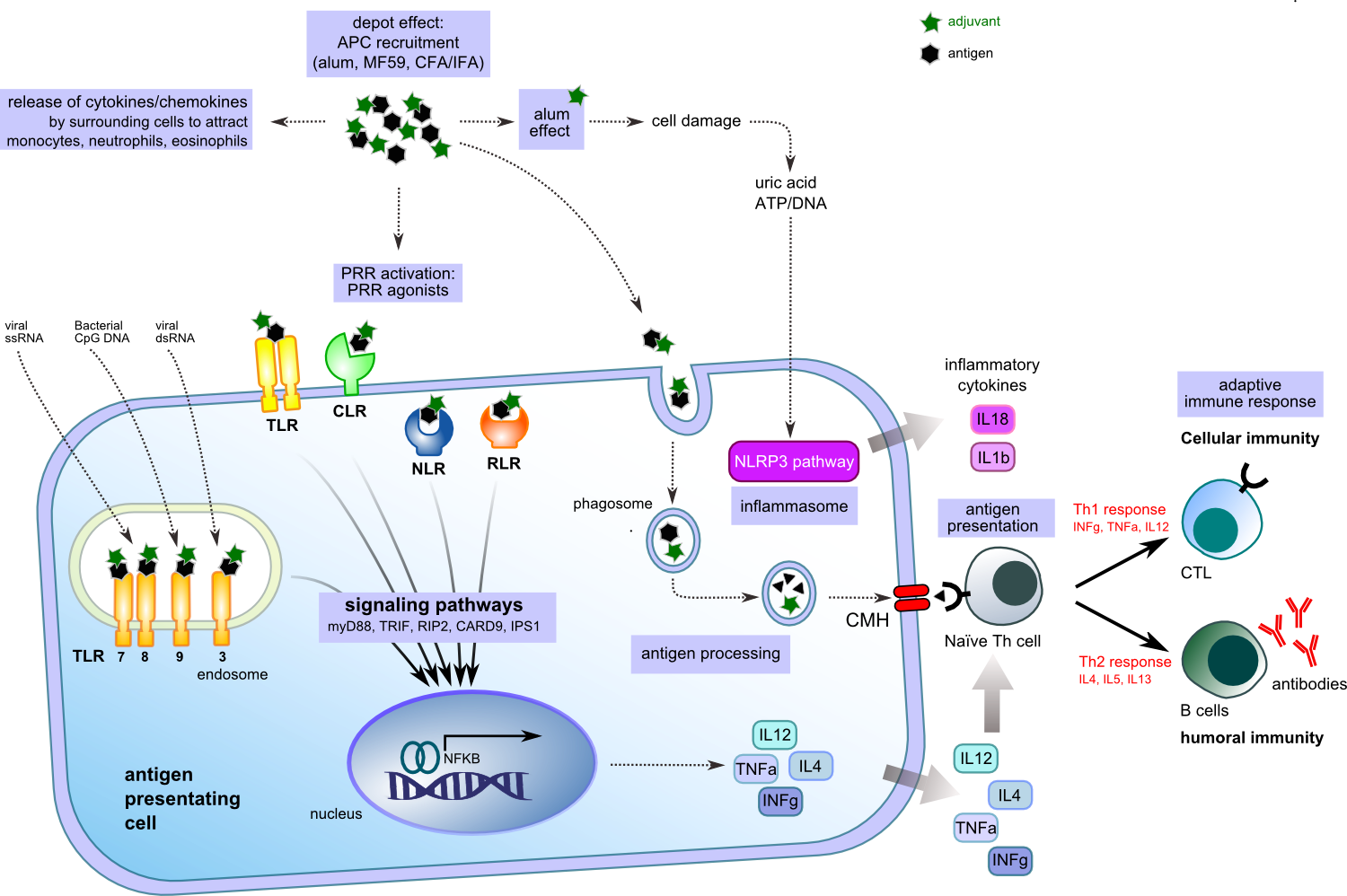
Рисунок 2. Активация APC адъювантом с антигеном.
Адъюванты Фройнда
Неполный адъювант Фройнда = сильный Th2 иммунный ответ + низкий ответ Th1
Полный адъювант Фройнда = сильный Th1 иммунный ответ
Неполный адъювант Фрейнда (IFA) IFAVax и полный адъювант Фрейнда (CFA) CFAVax являются водномасляной эмульсией, состоящей из смеси минерального масла и эмульгатора в соотношении 85% v/v масла и 15% v/v эмульгатора. В отличие от адъюванта Фрейнда (CFA), ИФА не содержит термически убитых микобактерий (Mycobacterum tuberculosis). IFA и CFA широко используются в экспериментальной иммунологии. IFA десятилетиями использовался в практической ветеринарной вакцинации. Важно отметить, что адъюванты Фрейнда не являются предварительно сформированными эмульсиями и, таким образом, они должны быть смешаны с равным объемом водного раствора антигенов, а затем эмульгированы перед использованием. Хотя механизмы действия масляный эмульсий до сих пор плохо изучены, некоторые доказательства указывают на частичное участие NOD2 в этом процессе. Кроме того, эти эмульсии склонны вызывать повреждение клеток при инъекции и, таким образом, эндогенные сигналы, выделяющиеся во время некротической смерти клеток, могут также способствовать их адъювантной активности. Иммунный ответ, направленный по CFA резко усиливается микобактериальным компонентом, который привлекает макрофаги и иммунные клетки в место инъекции. CFA индуцирует главным образом ответ Th1 и может вызвать гранулемы и интенсивную воспалительную реакцию в месте прививки. CFA следует использовать ответственно и с осторожностью, чтобы избежать или свести к минимуму неблагоприятные последствия чрезмерного воспаления. В отличие от CFA, индуцирующего главным образом Th1 ответ, IFA, лишенный микобактериальных компонентов, запускает Th2 ответ [11]. Для большинства приложений, CFA, как правило, необходим только для начальной иммунизации, в то время как IFA является больше подходит для последующих иммунизаций. Адъюванты IFAVax и CFAVax предназначены для обеспечения непрерывного высвобождения антигенов, необходимых для стимуляции сильного, длительного иммунного ответа.
Адъювант на основе алюминия (для иммунного ответа Th2)
Соединения алюминия являются наиболее распространенным адъювантом и используется в утвержденных профилактических вакцинах из-за его высокой безопасности и способности усиливать защитный гуморальный иммунный ответ (Th2). Он состоит из преципитатов фосфата алюминия и/или гидроксида алюминия, на которые антигены адсорбируются за счет гидрофобных и электростатических взаимодействий или попадания внутрь осадка. Гидроксид Alumax несет положительный заряд при физиологическом рН 7,4 и связывает кислые белки. Фосфат Alumax, с другой стороны, имеет отрицательный заряд и, следовательно, связывает основные белки. Ассоциация антигена с производными алюминия способствует высокой локальной концентрацией антигена и улучшает их поглощение APC. В ранних экспериментах было показано, что квасцы усиливает реакцию на антигены, увеличивая время доступности антигена. Кроме того, в настоящее время признается, что соединения алюминия, как и многие другие адъюванты, действует путем прямой активации клеток иммунной системы. У мышей, соединения алюминия индуцируют сильно поляризованный Th2 иммунный ответ, который характеризуется производством IL-4 и IL-5 и сильной индукцией производства антител - иммуноглобулинов IgE и IgG1 [12-13]. Следовательно, соединения алюминия очень эффективны против патогенных микроорганизмов, которые требуют Th2 гуморального иммунитета. Параллельно с этим, соединения алюминия способны активировать инфламмасому NLRP3 для получения зрелого IL-1, создавая благоприятные условия для иммунного ответа [14]. Тем не менее, данные вещества не могут индуцировать реакции Th1, связанные с индукцией ИНФ-гамма и цитотоксических Т-лимфоцитов, которые необходимы для защиты организма от внутриклеточных инфекций.
Различные соли алюминия содержатся в многочисленных лицензированных вакцинах (смотрите таблицу ниже) и их профили безопасности были проверены в течение длительного применения на людях [15].
Соли алюминия
|
Вакцины
|
Al(OH)3 – гидроксид алюминия
AlPO4 – фосфат алюминия
|
дифтерия, коклюш
столбняк, HBV - HAV
|
(Al)2PO4SO4OH – алюминий гидроксифосфат сульфат
|
HPV
|
HBV, вирус гепатита В; HAV, вирус гепатита А; HPV, вирус папиллом человека
|
|
Эмульсия сквалена (Сильный иммунный ответ – баланс ответов Th1/Th2)
SqualVax представляет собой эмульсию типа масло-в-воде из капель сквалена в непрерывной водной фазе. Капли сквалена стабилизированы путем добавления двух неионных поверхностно-активных веществ, которые широко используются в качестве эмульгаторов в пищевой, косметической и фармацевтической продукции [16]. Он полностью биоразлагаем, что является важным преимуществом по сравнению с альтернативными маслами, используемыми в качестве таких эмульсионных адъювантов, как адъювант Фрейнда, который содержит минеральное масло (парафиновое масло) и, таким образом, имеет длительный срок жизни в организмах.
Эмульсия сквалена вызывает местное раздражение и привлекает дендритные клетки и гранулоциты, стимулирует дифференцировку моноцитов в DC [17] и повышает поглощение антигена АРС [18]. Эмульсия действует в большей степени на макрофаги, находящихся в месте инъекции. Локальное увеличение высвобождения хемокинов также влияет на привлечение иммунных клеток из крови в месте прививки, создавая цикл амплификации. Данный состав усиливает дифференциацию моноцитов в направлении зрелого фенотипа и способствует миграции нагруженных антигеном клеток к лимфатическому узлу. По сравнению с солями алюминия, иммунный ответ от данного адъюванта получается сильнее (больше антител и более сильный Т-клеточный ответ) со смешанным и более сбалансированным клеточным фенотипом Th1 / Th2 [17]. Эмульсии сквалена присутствуют в лицензированных вакцинах против сезонного и пандемического гриппа. Они усиливают иммунный ответ в сложных популяциях, таких как пожилые люди, и могут способствовать иммунному ответу против конкретных вариантов вируса сезонного гриппа, не входящих в состав вакцины [19].
Состав SqualVax аналогичен MF59® (зарегистрированная торговая марка компании Novartis). MF59 используется только для целей сравнения. SqualVax ™ не производится, не аффилирован, не спонсируется и не поддерживается Novartis. Novartis не производил оценку и не давал одобрения настоящему документу.
БИБЛИОГРАФИЯ
1. van Kooyk Y., et al., Curr Opin Immunol, 2004. 16(4): p. 488-93.
2. Akira S., Philos Trans R Soc Lond B Biol Sci, 2011. 366(1579): p. 2748-55.
3. Iwasaki A. and R. Medzhitov, Science, 2010. 327(5963): p. 291-5.
4. Cox J.C. and A.R. Coulter, Vaccine, 1997. 15(3): p. 248-56.
5. Medzhitov R. and C. Janeway Jr., N Engl J Med, 2000. 343(5): p. 338-44.
6. Elinav E., et al., Immunity, 2011. 34(5): p. 665-79.
7. Kawai T. and S. Akira, Immunity, 2011. 34(5): p. 637-50.
8. Loo Y.M. and M. Gale Jr., Immunity, 2011. 34(5): p. 680-92.
9. Osorio F. and C. Reis e Sousa, Immunity, 2011. 34(5): p. 651-64.
10. Reed S.G et al., Nat Med, 2013. 19(12): p. 1597-608.
11. Lindblad E.B., et al., Infect Immun, 1997. 65(2): p. 623-9.
12. Marrack P., A.S. McKee, and M.W. Munks, Nat Rev Immunol, 2009. 9(4): p. 287-93.
13. Aimanianda V., et al., Trends Pharmacol Sci, 2009. 30(6): p. 287-95.
14. Li H.S. Nookala, and F. Re, J Immunol, 2007. 178(8): p. 5271-6.
15. Singh M., et al., Vaccine, 2006. 24(10): p. 1680-6.
16. O'Hagan D.T., Expert Rev Vaccines, 2007. 6(5): p. 699-710.
17. Seubert A., et al., J Immunol, 2008. 180(8): p. 5402-12.
18. Dupuis M., et al., Cell Immunol, 1998. 186(1): p. 18-27.
19. Podda A., Vaccine, 2001. 19(17-19): p. 2673-80.
Информация представлена исключительно в ознакомительных целях и ни при каких условиях не является публичной офертой